" A mente que se abre a uma nova ideia jamais voltará ao seu tamanho original" Albert Einstein "Nada se perde, tudo se transforma , desde que se queira" Valéria Vendramini
domingo, 27 de novembro de 2011
quinta-feira, 3 de novembro de 2011
Atividade de recuperação 3º Ano - 4º Bimestre
Atividade de recuperação 3º Ano - 4º Bimestre
1-Qual das propriedades abaixo é comum a todos os líquidos?
a) Transformar-se em gases acima de 100°C.
b) Solidificarem-se abaixo de 0°C.
c) Formarem, entre si, misturas heterogêneas.
d) Ferverem à temperatura constante, independentemente de serem puros ou não.
e) Apresentarem pressões de vapor diferentes a temperaturas diferentes.
a) Transformar-se em gases acima de 100°C.
b) Solidificarem-se abaixo de 0°C.
c) Formarem, entre si, misturas heterogêneas.
d) Ferverem à temperatura constante, independentemente de serem puros ou não.
e) Apresentarem pressões de vapor diferentes a temperaturas diferentes.
2-Complete a frase: O aumento da temperatura acarreta um ______ na pressão de vapor de um líquido.
3-Sabendo-se que:
I) NaCl(s) ® Na+(g) + Cl–(g)
Responda: a) essa reação é de síntese ou decomposição?
4- (UFAC)
A reação: H2 (g) + ½ O2 (g) ® H2 O (L) é exotérmica porque:
a) absorve calor
b) libera oxigênio
c) é higroscópica
d) perde água
e) libera calor
5-O que é energia de ligação? dê um exemplo.
Atividade de recuperação - 2º Ano - 4º Bimestre
Atividade de recuperação - 2º Ano - 4º Bimestre
1-(MED. POUSO ALEGRE) O nome sistemático de acordo com a IUPAC para a estrutura
a) 2,3 - dimetil - 1 - pentanol
b) 2,3 - dimetil pentanol
c) 2 - metil - 3 etil - 1 - butanol
d) 2 - metil - 3 - etil butazona
e) 2,3 dimetil - 3 - etil - 1 propanol
2-De acordo com a IUPAC, qual o nome do composto da fórmula a seguir?
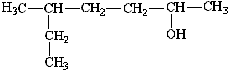
a) 5 - etil - 2 - hexanol
b) 3 - metil - 6 - heptanol
c) 2 - etil - 2 - hexano
d) 5 - metil - 2 - heptanol
e) 2 - cloro - 3 - metil hexano
3- (FMTM / 2000)
“Titã, a lua de Saturno, será o único corpo celeste do sistema solar, além da Terra, a possuir um oceano em sua superfície. Nesse caso, é de se supor que tenha também cataratas, rios e lagos formados de etano, propano e outras substâncias orgânicas. Ainda mais interessante, do ponto de vista dos cientistas, é a atmosfera do satélite, rica em hidrogênio molecular, gás carbônico, metano e outros hidrocarbonetos, o que faria chover gasolina.” (Revista Galileu, n° 104, março / 2000)
Dê as fórmulas dos hidrocarbonetos, cujos nomes foram dados no texto, e da substância simples mencionada.
4- O que é Biomassa? Dê exemplo.
1-(MED. POUSO ALEGRE) O nome sistemático de acordo com a IUPAC para a estrutura
H3C — CH2 — CH — CH — CH2 — OH é:
| |
CH3 CH3
| |
CH3 CH3
a) 2,3 - dimetil - 1 - pentanol
b) 2,3 - dimetil pentanol
c) 2 - metil - 3 etil - 1 - butanol
d) 2 - metil - 3 - etil butazona
e) 2,3 dimetil - 3 - etil - 1 propanol
2-De acordo com a IUPAC, qual o nome do composto da fórmula a seguir?
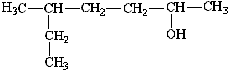
a) 5 - etil - 2 - hexanol
b) 3 - metil - 6 - heptanol
c) 2 - etil - 2 - hexano
d) 5 - metil - 2 - heptanol
e) 2 - cloro - 3 - metil hexano
3- (FMTM / 2000)
Dê as fórmulas dos hidrocarbonetos, cujos nomes foram dados no texto, e da substância simples mencionada.
4- O que é Biomassa? Dê exemplo.
sábado, 15 de outubro de 2011
Atividade de recuperação - 4º Bimestre - 1º Ano ensino médio
Exercícios
1-Verifique se as equações a seguir estão balanceadas:
a) 11 H2O + 12 CO2 _______ C12H22O11 + 12 O2 está balanceada
b) NH3 __________ N2 + 3H2 não está balanceada
2-Informe se as seguintes reações químicas são reação de síntese ou decomposição:
a) 2H2 + O2 → 2 H2O R: reação de síntese
b) C (s) + O2 (g) → CO2 (g) R: reação de síntese
c) NH4NO3 → N2O + H2O R: reação de decomposição
3-Quantos átomos de cada elemento existem na fórmula: Fe2O3
R: Dois átomos de Ferro e três átomos de oxigênio
4-Quantos átomos de cada elemento existem na fórmula: Al2(SO4)3
R: Dois átomos de Alumínio, três átomos de enxofre e doze átomos de oxigênio
sábado, 8 de outubro de 2011
sábado, 17 de setembro de 2011
sábado, 3 de setembro de 2011
Atividade de recuperação referente ao 3ºBimestre - 3ºAno
Lista de exercícios referente ao 3º bimestre de recuperação – 3º Ano
1-Observe a equação:
3NO2 + H2O _________> 2 HNO3 + NO
Responda:
a) Ocorre oxi-redução? B) O nox aumentou?
2- As moléculas do gás produzido na reação entre sulfeto de sódio sólido e ácido sulfúrico diluído são formadas por:
a)( )2 átomos
b)( )3 átomos
c)( )6 átomos
d)( )18 átomos
3-Na reação de neutralização total do ácido sulfídrico com o hidróxido de potássio, há formação de sal e água. Assinale a alternativa que contenha a fórmula e o nome corretos deste sal:
a)( ) KS – sulfeto de potássio
b)( ) K2S – sulfeto de potássio
c)( ) HKS – sulfeto de hidropenpotássio
d)( ) K2SO4 – sulfato de potássio
4- O que são soluções saturadas e insaturadas?
1-Observe a equação:
3NO2 + H2O _________> 2 HNO3 + NO
Responda:
a) Ocorre oxi-redução? B) O nox aumentou?
2- As moléculas do gás produzido na reação entre sulfeto de sódio sólido e ácido sulfúrico diluído são formadas por:
a)( )2 átomos
b)( )3 átomos
c)( )6 átomos
d)( )18 átomos
3-Na reação de neutralização total do ácido sulfídrico com o hidróxido de potássio, há formação de sal e água. Assinale a alternativa que contenha a fórmula e o nome corretos deste sal:
a)( ) KS – sulfeto de potássio
b)( ) K2S – sulfeto de potássio
c)( ) HKS – sulfeto de hidropenpotássio
d)( ) K2SO4 – sulfato de potássio
4- O que são soluções saturadas e insaturadas?
Atividade referente ao 3ºBimestre - 2ºAno
Lista de exercícios referente ao 3º bimestre de recuperação – 2º Ano
1-O que reatividade?
2-Um analista fez uma experiência para calcular a velocidade média de consumo da amônia em diferentes intervalos de tempo e obteve:
Entre a e 1h: Vm de 4,0 mol/L . h
Entre 1 e 2 h: Vm de 2,0 mol/L . h
Entre 2 e 3 h: Vm de 1,0 mol/L . h
Com esses dados a velocidade da reação é constante?
( )sim ( )não
3-Pode se afirmar que quanto maior for a concentração dos reagentes, maior será a velocidade e uma reação química?
4-O que são compostos orgânicos?
1-O que reatividade?
2-Um analista fez uma experiência para calcular a velocidade média de consumo da amônia em diferentes intervalos de tempo e obteve:
Entre a e 1h: Vm de 4,0 mol/L . h
Entre 1 e 2 h: Vm de 2,0 mol/L . h
Entre 2 e 3 h: Vm de 1,0 mol/L . h
Com esses dados a velocidade da reação é constante?
( )sim ( )não
3-Pode se afirmar que quanto maior for a concentração dos reagentes, maior será a velocidade e uma reação química?
4-O que são compostos orgânicos?
Atividade de recuperação referente ao 3º Bimestre 1º Ano
Lista de exercícios para 1º Ano – 3º Bimestre – Recuperação
1-Complete a frase:
a) As substâncias formadas por ligação covalente são chamadas de substâncias moleculares.Podem ser sólidas,-------------- ou -----------------------.
b) Denomina-se eletronegatividade a capacidade que os átomos de um determinado elemento possuem para atrair---------.
2- As configurações eletrônicas das camadas de valência dos elementos X e Y são,respectivamente, 5s2 e 2s2 2p4. O composto resultante da combinação de X e Y é:
a) XY2 , covalente
b) X2Y , iônico
c) XY , covalente
3- Qual o elemento mais eletronegativo da tabela periódica?
4-A acidez estomacal, provocada pelo ácido clorídrico, pode ser neutralizada utilizando- se uma solução de:
a)Cloreto de sódio
b) Hidróxido de Magnésio
1-Complete a frase:
a) As substâncias formadas por ligação covalente são chamadas de substâncias moleculares.Podem ser sólidas,-------------- ou -----------------------.
b) Denomina-se eletronegatividade a capacidade que os átomos de um determinado elemento possuem para atrair---------.
2- As configurações eletrônicas das camadas de valência dos elementos X e Y são,respectivamente, 5s2 e 2s2 2p4. O composto resultante da combinação de X e Y é:
a) XY2 , covalente
b) X2Y , iônico
c) XY , covalente
3- Qual o elemento mais eletronegativo da tabela periódica?
4-A acidez estomacal, provocada pelo ácido clorídrico, pode ser neutralizada utilizando- se uma solução de:
a)Cloreto de sódio
b) Hidróxido de Magnésio
sábado, 18 de junho de 2011
REsumo da revisão para o 3º ano 2º bimestre
Revisão para 3º ano – 2
Equilíbrio Químico
- Equilíbrio químico é a parte da físico-química que estuda as
reações reversíveis e as condições para o estabelecimento desta
atividade equilibrada.
A causa do estabelecimento do equilíbrio químico é a nivelação
das velocidades da reação direta (para a direita) e a da inversa (para
a esquerda) que se realiza como conseqüência das mudanças de
concentração das substâncias.
- Duas condições são fundamentais para que se estabeleça o
equilíbrio químico: que o sistema esteja fechado e que a
temperatura e pressão permaneçam constantes.
Equilíbrio iônico é o estudo dos equilíbrios químicos envolvendo soluções aquosas de ácidos e bases, que apresentam partículas iônicas e moléculas não ionizadas.
Para ácidos: Ka
Maior Ka = maior força ácida
Para Bases: Kb
Maior Kb = maior força básica
Resposta do exercício:pH= 6,7
Equilíbrio Químico
- Equilíbrio químico é a parte da físico-química que estuda as
reações reversíveis e as condições para o estabelecimento desta
atividade equilibrada.
A causa do estabelecimento do equilíbrio químico é a nivelação
das velocidades da reação direta (para a direita) e a da inversa (para
a esquerda) que se realiza como conseqüência das mudanças de
concentração das substâncias.
- Duas condições são fundamentais para que se estabeleça o
equilíbrio químico: que o sistema esteja fechado e que a
temperatura e pressão permaneçam constantes.
Equilíbrio iônico é o estudo dos equilíbrios químicos envolvendo soluções aquosas de ácidos e bases, que apresentam partículas iônicas e moléculas não ionizadas.
Para ácidos: Ka
Maior Ka = maior força ácida
Para Bases: Kb
Maior Kb = maior força básica
Resposta do exercício:pH= 6,7
terça-feira, 31 de maio de 2011
Lista de exercícios - 3º ano ensino médio referente ao 2º bimestre
Nome: nº série:
1- Entre os líquidos da tabela:
H+ OH-
Leite 1,0 . 10-7 1,0 . 10-7
Água 1,0 . 10-8 1,0 . 10-6
Coca-cola 1,0 . 10-3 1,0 . 10-11
Café preparado 1,0 . 10-5 1,0 . 10-9
Lágrima 1,0 . 10-7 1,0 . 10-7
Quais têm caráter ácido?
2-Qual o efeito produzido sobre o equilíbrio:
2NO(g) + O2 (g) ___________ 2NO2 (g)
a)Aumento da NO ? b) diminuição O2? c) aumento o O2 ?
3-O que é hidrólise salina?
4-Observe as equações e informe o agente redutor e o agente oxidante:
a)Zn(s) + 2 H+ (aq)_______________ H2 (g) + Zn2+ (aq)
b)Fe2O3 (s) + 3 CO(g)______________2Fe (s) + 3CO2 (g)
5-Assinale o número de oxidação INCORRETO:
a) Li = -1
b) N = +5
c) S = -2
d) Cl = -1
e) Sr = +2
Nome: nº série:
1- Entre os líquidos da tabela:
H+ OH-
Leite 1,0 . 10-7 1,0 . 10-7
Água 1,0 . 10-8 1,0 . 10-6
Coca-cola 1,0 . 10-3 1,0 . 10-11
Café preparado 1,0 . 10-5 1,0 . 10-9
Lágrima 1,0 . 10-7 1,0 . 10-7
Quais têm caráter ácido?
2-Qual o efeito produzido sobre o equilíbrio:
2NO(g) + O2 (g) ___________ 2NO2 (g)
a)Aumento da NO ? b) diminuição O2? c) aumento o O2 ?
3-O que é hidrólise salina?
4-Observe as equações e informe o agente redutor e o agente oxidante:
a)Zn(s) + 2 H+ (aq)_______________ H2 (g) + Zn2+ (aq)
b)Fe2O3 (s) + 3 CO(g)______________2Fe (s) + 3CO2 (g)
5-Assinale o número de oxidação INCORRETO:
a) Li = -1
b) N = +5
c) S = -2
d) Cl = -1
e) Sr = +2
Lista de exercícios 2º ano - 2º Bimestre
Lista de exercícios – 2º ano – 2º bimestre
Nome: nº série:
1-Qual das propriedades abaixo é comum a todos os líquidos?
a) Transformar-se em gases acima de 100°C.
b) Solidificarem-se abaixo de 0°C.
c) Formarem, entre si, misturas heterogêneas.
d) Ferverem à temperatura constante, independentemente de serem puros ou não.
e) Apresentarem pressões de vapor diferentes a temperaturas diferentes.
2-Complete a frase: O aumento da temperatura acarreta um ______ na pressão de vapor de um líquido.
3-Sabendo-se que:
HCl(aq) + NaOH(aq)_________ NaCl (aq) + H2O(l) ∆ H = - 13,8 kcal
Pergunta-se:
a) A reação é exotérmica ou endotérmica?
b) Qual a quantidade de calor envolvida na neutralização de 146 g de HCl (aq), sendo a equação acima?
4- (UDESC 2010)
Dados os calores de reação nas condições padrões para as reações químicas abaixo:
H2(g) + ½ O2(g)______ H2O(l) ∆H = -68,3 Kcal
C(s) + O2(g)____________ CO2(g) ∆H =-94,0 Kcal
C2H2(g) + 5/2 O2(g) ____________2CO2(g) +H2O(l) ∆H =-310,6Kcal
Pode-se afirmar que a entalpia padrão do acetileno, em kcal/mol, é:
A) – 310,6
B) _ 222,5
C) _ 54,3
D) + 54,3
E) + 222,5
5-(UFSE) Ao aproximar um palito em brasa da boca de uma proveta que contém hidrogênio, ocorre explosão da mistura gasosa formada pelo hidrogênio com o oxigênio do ar. Esta é uma indicação de que a reação ocorrida, nestas condições, é:
(A) lenta e endotérmica.
(B) lenta e exotérmica.
(C) rápida e sem variação de volume.
(D) rápida e endotérmica.
(E) rápida e exotérmica.
Nome: nº série:
1-Qual das propriedades abaixo é comum a todos os líquidos?
a) Transformar-se em gases acima de 100°C.
b) Solidificarem-se abaixo de 0°C.
c) Formarem, entre si, misturas heterogêneas.
d) Ferverem à temperatura constante, independentemente de serem puros ou não.
e) Apresentarem pressões de vapor diferentes a temperaturas diferentes.
2-Complete a frase: O aumento da temperatura acarreta um ______ na pressão de vapor de um líquido.
3-Sabendo-se que:
HCl(aq) + NaOH(aq)_________ NaCl (aq) + H2O(l) ∆ H = - 13,8 kcal
Pergunta-se:
a) A reação é exotérmica ou endotérmica?
b) Qual a quantidade de calor envolvida na neutralização de 146 g de HCl (aq), sendo a equação acima?
4- (UDESC 2010)
Dados os calores de reação nas condições padrões para as reações químicas abaixo:
H2(g) + ½ O2(g)______ H2O(l) ∆H = -68,3 Kcal
C(s) + O2(g)____________ CO2(g) ∆H =-94,0 Kcal
C2H2(g) + 5/2 O2(g) ____________2CO2(g) +H2O(l) ∆H =-310,6Kcal
Pode-se afirmar que a entalpia padrão do acetileno, em kcal/mol, é:
A) – 310,6
B) _ 222,5
C) _ 54,3
D) + 54,3
E) + 222,5
5-(UFSE) Ao aproximar um palito em brasa da boca de uma proveta que contém hidrogênio, ocorre explosão da mistura gasosa formada pelo hidrogênio com o oxigênio do ar. Esta é uma indicação de que a reação ocorrida, nestas condições, é:
(A) lenta e endotérmica.
(B) lenta e exotérmica.
(C) rápida e sem variação de volume.
(D) rápida e endotérmica.
(E) rápida e exotérmica.
quinta-feira, 19 de maio de 2011
Lista referente ao 2 bimestre - 1º Ano
Lista de Exercícios 1ª Ano 2º Bimestre
1-Anotação Fe 56 e 26 indicam:
a) 26 átomos de ferro de número de massa 56.
b) 26 átomos grama de ferro de número de massa 56.
c) Um isóbaro de ferro de número de massa 56.
d) Um isótono de ferro de número de massa 56.
e) Isótopo de ferro de número de massa 56.
2- A questão deve ser respondida de acordo com o seguinte código:
A teoria de Dalton admitia que:
I. Átomos são partículas discretas de matéria que não podem ser divididas por qualquer processo químico conhecido;
II. Átomos do mesmo elemento químico são semelhantes entre si e têm mesma massa;
III. Átomos de elementos diferentes têm propriedades diferentes.
a) Somente I é correta.
b) Somente II é correta.
c) Somente III é correta.
d) I, II, III são corretas.
e) I e III são corretas.
3- O átomo constituído de 17 prótons, 18 nêutrons e 17 elétrons, possui número atômico e número de massa igual a:
a) 17 e 17
b) 17 e 18
c) 18 e 17
d) 17 e 35
e) 35 e 17
4-O átomo neutro de alumínio Al 27(A) e 13(P) contém:
a)27 prótons b) 40 prótons c) 14 nêutrons d) 13 nêutrons
5-Faça a distribuição eletrônica do: a)Flúor b)Cálcio c) Cloro
1-Anotação Fe 56 e 26 indicam:
a) 26 átomos de ferro de número de massa 56.
b) 26 átomos grama de ferro de número de massa 56.
c) Um isóbaro de ferro de número de massa 56.
d) Um isótono de ferro de número de massa 56.
e) Isótopo de ferro de número de massa 56.
2- A questão deve ser respondida de acordo com o seguinte código:
A teoria de Dalton admitia que:
I. Átomos são partículas discretas de matéria que não podem ser divididas por qualquer processo químico conhecido;
II. Átomos do mesmo elemento químico são semelhantes entre si e têm mesma massa;
III. Átomos de elementos diferentes têm propriedades diferentes.
a) Somente I é correta.
b) Somente II é correta.
c) Somente III é correta.
d) I, II, III são corretas.
e) I e III são corretas.
3- O átomo constituído de 17 prótons, 18 nêutrons e 17 elétrons, possui número atômico e número de massa igual a:
a) 17 e 17
b) 17 e 18
c) 18 e 17
d) 17 e 35
e) 35 e 17
4-O átomo neutro de alumínio Al 27(A) e 13(P) contém:
a)27 prótons b) 40 prótons c) 14 nêutrons d) 13 nêutrons
5-Faça a distribuição eletrônica do: a)Flúor b)Cálcio c) Cloro
sexta-feira, 18 de fevereiro de 2011
lista de exercícios para o 3º ano
Lista de exercícios – 3º ANO
Nome: série:
1. Em determinada experiência, a reação de formação de água está ocorrendo com o consumo de 4 mols de oxigênio por minuto. Conseqüentemente, a velocidade de consumo de hidrogênio é de:
a) 8 mols/minuto
b) 4 mols/minuto
c) 12 mols/minuto
d) 2 mols/minuto
e) n.d.a.
2. Por que o catalisador altera velocidade de uma reação?
3.Cite um exemplo de material que pode ser adicionado ao solo para diminuir sua acidez?
4. O vinagre tem caráter ácido, pois nele
encontramos, predominantemente:
a) ácido sulfúrico. c) ácido nítrico.
b) ácido acético. d) ácido sulfônico.
5.Segundo a definição de Arrhenius, as
bases são espécies que, em solução aquosa:
a) fornecem íons OH-.
b) fornecem íons H+.
c) recebem íons OH-.
d) recebem íons H+.do carbônico.
6. Juntando-se cloreto de sódio a uma solução diluída de ácido clorídrico, o pH da solução:
a) diminui.
b) aumenta.
c) permanece praticamente constante.
d) diminui, passa por um mínimo e volta ao valor original.
e) aumenta, passa por um máximo e volta ao valor original.
Nome: série:
1. Em determinada experiência, a reação de formação de água está ocorrendo com o consumo de 4 mols de oxigênio por minuto. Conseqüentemente, a velocidade de consumo de hidrogênio é de:
a) 8 mols/minuto
b) 4 mols/minuto
c) 12 mols/minuto
d) 2 mols/minuto
e) n.d.a.
2. Por que o catalisador altera velocidade de uma reação?
3.Cite um exemplo de material que pode ser adicionado ao solo para diminuir sua acidez?
4. O vinagre tem caráter ácido, pois nele
encontramos, predominantemente:
a) ácido sulfúrico. c) ácido nítrico.
b) ácido acético. d) ácido sulfônico.
5.Segundo a definição de Arrhenius, as
bases são espécies que, em solução aquosa:
a) fornecem íons OH-.
b) fornecem íons H+.
c) recebem íons OH-.
d) recebem íons H+.do carbônico.
6. Juntando-se cloreto de sódio a uma solução diluída de ácido clorídrico, o pH da solução:
a) diminui.
b) aumenta.
c) permanece praticamente constante.
d) diminui, passa por um mínimo e volta ao valor original.
e) aumenta, passa por um máximo e volta ao valor original.
Lista de exercícios para o 2º Ano
Lista de Exercícios : 2º ANO
Nome: série:
1. A concentração de ácido acético (C2H4O2) no vinagre é da ordem de 0,83 M. Aproximadamente, quantos gramas desse ácido há em 1 litro de vinagre? Dados: C = 12; H = 1; O =16
a) 10 g
b) 20 g
c) 30 g
d) 40 g
e) 50 g
2. Um adulto Possi, em média, 5 L de sangue com cloreto de sódio dissolvido na concentração de 5,8 g/L. Qual a massa total de NaCl no sangue de uma pessoa adulta?
3. No tratamento de água para que serve a floculação e a decantação?
4.Uma solução contendo 14g de cloreto de sódio dissolvidos em 200mL de água foi deixada em um frasco aberto, a 30°C. Após algum tempo, começou a cristalizar o soluto. Qual volume mínimo e aproximado, em mL, de água deve ter evaporado quando se iniciou a cristalização?
Dados:
solubilidade, a 30°C, do cloreto de sódio = 35g/100g de água; densidade da água a 30°C = 1,0g/mL.
a) 20.
b) 40.
c) 80.
d) 100.
e) 160.
5. como reutilizar a água?
Nome: série:
1. A concentração de ácido acético (C2H4O2) no vinagre é da ordem de 0,83 M. Aproximadamente, quantos gramas desse ácido há em 1 litro de vinagre? Dados: C = 12; H = 1; O =16
a) 10 g
b) 20 g
c) 30 g
d) 40 g
e) 50 g
2. Um adulto Possi, em média, 5 L de sangue com cloreto de sódio dissolvido na concentração de 5,8 g/L. Qual a massa total de NaCl no sangue de uma pessoa adulta?
3. No tratamento de água para que serve a floculação e a decantação?
4.Uma solução contendo 14g de cloreto de sódio dissolvidos em 200mL de água foi deixada em um frasco aberto, a 30°C. Após algum tempo, começou a cristalizar o soluto. Qual volume mínimo e aproximado, em mL, de água deve ter evaporado quando se iniciou a cristalização?
Dados:
solubilidade, a 30°C, do cloreto de sódio = 35g/100g de água; densidade da água a 30°C = 1,0g/mL.
a) 20.
b) 40.
c) 80.
d) 100.
e) 160.
5. como reutilizar a água?
Lista de exercícios para o 1º Ano(B,C e D)-Química
Lista de exercício 1º Ano
1.Associe às transformações seguintes a letra F quando se trata de transformações físicas e a letra Q quando se trata de transformações químicas.
a - um fósforo a arder
b - congelamento da água
c - rasgar uma folha de papel
d - enferrujamento de um portão de ferro
2.Qual dos seguintes processos pode ser usado para extrair sal de cozinha da água do mar?
a) Filtração
b) Decantação
c) Destilação
d) Diluição
e) Eletroforese
3.Um bloco de metal tem volume de 200 ml e massa de 1792 g.Qual a densidade desse metal,expressa em g/cm3 ?
Lembrete: densidade= massa
Volume
1m³ = 1000 litros
1cm³ = 1 ml (mililitro)
4.Considere o que se observa quando um comprimido
antiácido efervescente é acrescentado à água, ou
seja, a rápida produção de gás. Essa observação
leva a concluir o seguinte:
(A) evaporando-se a solução aquosa obtida após a
liberação de gás, obtém-se o comprimido.
(B) a mistura “comprimido efervescente e água”
resultou em transformação química.
(C) o comprimido efervescente decompõe a água
em seus dois gases constituintes, H2 e O2.
(D) o gás produzido é tóxico e a solução resultante
não deve ser ingerida se apresentar bolhas.
(E) o comprimido fez com que houvesse liberação
dos gases, que estavam dissolvidos na água.
5.O petróleo é o recurso natural a partir do qual se obtêm
(A) plásticos, como o polietileno.
(B) combustíveis, como o biodiesel.
(C) gorduras, como a margarina.
(D) ligas metálicas, como o aço.
(E) desinfetantes, como a água sanitária
1.Associe às transformações seguintes a letra F quando se trata de transformações físicas e a letra Q quando se trata de transformações químicas.
a - um fósforo a arder
b - congelamento da água
c - rasgar uma folha de papel
d - enferrujamento de um portão de ferro
2.Qual dos seguintes processos pode ser usado para extrair sal de cozinha da água do mar?
a) Filtração
b) Decantação
c) Destilação
d) Diluição
e) Eletroforese
3.Um bloco de metal tem volume de 200 ml e massa de 1792 g.Qual a densidade desse metal,expressa em g/cm3 ?
Lembrete: densidade= massa
Volume
1m³ = 1000 litros
1cm³ = 1 ml (mililitro)
4.Considere o que se observa quando um comprimido
antiácido efervescente é acrescentado à água, ou
seja, a rápida produção de gás. Essa observação
leva a concluir o seguinte:
(A) evaporando-se a solução aquosa obtida após a
liberação de gás, obtém-se o comprimido.
(B) a mistura “comprimido efervescente e água”
resultou em transformação química.
(C) o comprimido efervescente decompõe a água
em seus dois gases constituintes, H2 e O2.
(D) o gás produzido é tóxico e a solução resultante
não deve ser ingerida se apresentar bolhas.
(E) o comprimido fez com que houvesse liberação
dos gases, que estavam dissolvidos na água.
5.O petróleo é o recurso natural a partir do qual se obtêm
(A) plásticos, como o polietileno.
(B) combustíveis, como o biodiesel.
(C) gorduras, como a margarina.
(D) ligas metálicas, como o aço.
(E) desinfetantes, como a água sanitária
Assinar:
Postagens (Atom)